

浏览量:2090
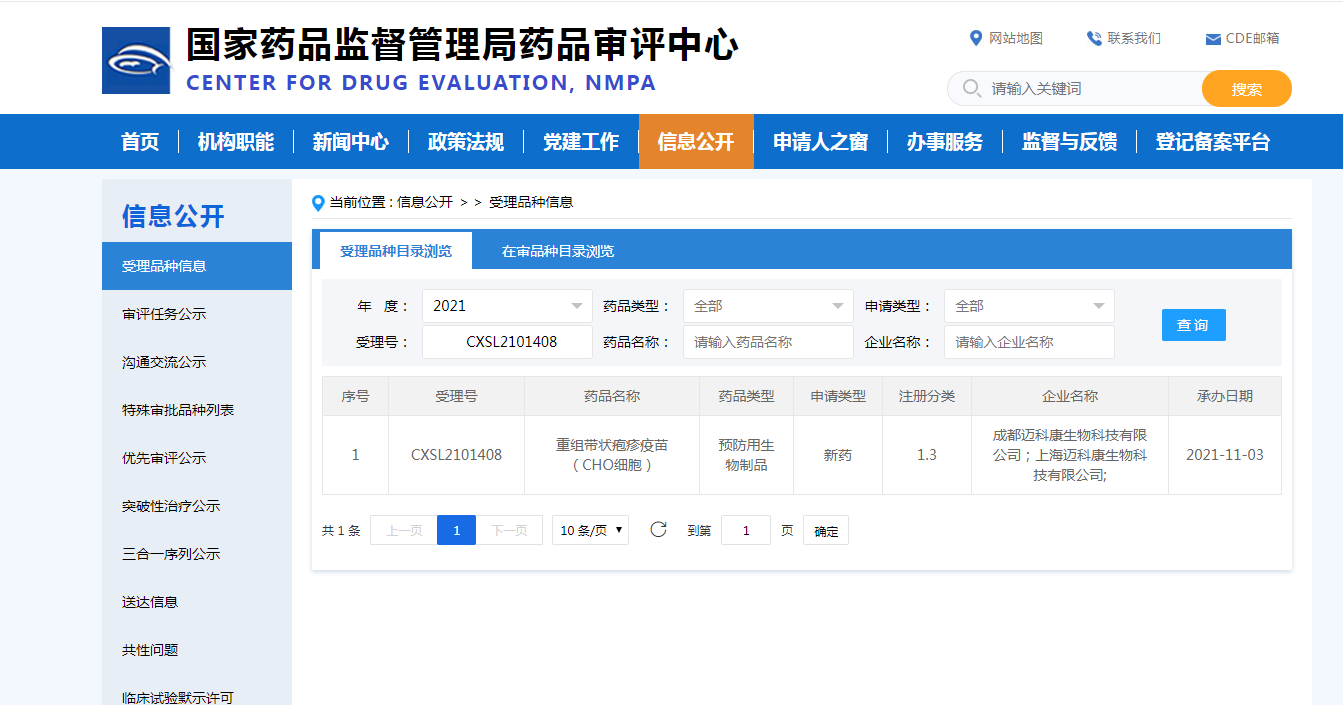
2021年11月03日,成都迈科康生物科技有限公司、上海迈科康生物科技有限公司联合申报的重组带状疱疹疫苗(CHO细胞)临床试验申请获得国家药品监督管理局的受理通知书(受理号:CXSL2101408)。自受理之日起60日内,未收到药审中心否定或质疑意见,迈科康生物可以按照提交的方案开展临床试验。
带状疱疹因水痘-带状疱疹病毒(VZV)再激活所致。绝大部分成人的神经系统中都有潜伏的水痘-带状疱疹病毒,当受到某种刺激(如创伤、疲劳、恶性肿瘤或病后虚弱等)导致免疫力降低时,潜伏病毒被激活,并沿神经纤维移至皮肤,使受侵犯的神经和皮肤发生炎症、坏死,产生神经痛。我国每年有近300万人受带状疱疹影响,50岁及以上人群每年新发带状疱疹病例约156万例。
迈科康生物研制的重组带状疱疹疫苗采用CHO细胞表达的重组VZV糖蛋白E和公司自创的MA105佐剂系统。临床前研究显示,本品能够同时诱导产生高水平的结合抗体和高频数的CD4+ T细胞反应,并且有足够的安全性数据支持。相较于减毒技术路线,本品能够提供更强的细胞免疫。目前全球范围内已上市的仅有葛兰素史克公司的带状疱疹重组亚单位疫苗和美国默克公司的带状疱疹减毒活疫苗。
当前,我国正处于老龄化发展阶段,带状疱疹易感人群数量逐年上升,加速研制安全有效的带状疱疹疫苗,将为全面推进中国健康老龄化发展发挥作用。截止目前,迈科康生物已有两条重磅管线申报临床,其中针对婴幼儿人群的重组轮状病毒疫苗已进入临床试验阶段。